पाठ 4 परमाणु की संरचना
पाठ के बीच में पूछे जाने वाले सवाल (पेज-53)
प्रश्न 1 – केनाल किरणें क्या हैं?
उत्तर :- एनोड से उत्पन्न होने वाली+आवेशित किरणों को केनाल किरणें कहा जाता है। जिसका पता जे.जे. टॉमसन ने लगाया था। इलेक्ट्रॉन के संबंध में जानकारी प्राप्त होने के पहले, ई. गोल्डस्टीन ने 1886 में एक नए विकिरण की खोज की, जिसे उन्होंने ‘केनाल रे’ का नाम दिया। ये किरणें धनावेशित विकिरण थी, जिसके द्वारा अंतत: दूसरे अवपरमाणुक कणों की खोज हुई। इन कणों का आवेश इलेक्ट्रॉन के आवेश के बराबर, किंतु विपरीत था।
प्रश्न 2 – यदि किसी परमाणु में एक इलेक्ट्रॉन और एक प्रोटॉन है, तो इसमें कोई आवेश होगा या नहीं?
उत्तर :- यदि किसी परमाणु में एक इलेक्ट्रॉन और एक प्रोटॉन है, तो इसमें कोई आवेश नहीं होगा, क्योंकि एक इलेक्ट्रॉन के पास 1- आवेश होता है और एक प्रोटीन के पास +1 आवेश होता है। ऐसा माना गया है कि परमाणु प्रोटॉन और इलेक्ट्रॉन से बने हैं, जो परस्पर आवेशों को संतुलित करते हैं।
पाठ के बीच में पूछे जाने वाले सवाल (पेज-56)
प्रश्न 1 – परमाणु उदासीन है, इस तथ्य को टॉमसन के मॉडल के आधार पर स्पष्ट कीजिए।
उत्तर :- टॉमसन ने परमाणु की संरचना से संबंधित एक मॉडल प्रस्तुत किया, जो क्रिसमस केक की तरह था। इनके अनुसार परमाणु एक धनावेशित गोला था। जिसमें इलेक्ट्रॉनिक क्रिसमस केक में लगे सूखे मेवे की तरह थे। टॉमसन ने प्रस्तावित किया कि परमाणु धन आवेशित गोले का बना होता है और इलेक्ट्रॉन उसमें धसे होते हैं। +और -आवेश परिणाम में समान होते हैं। इसलिए परमाणु वैद्युतीय रूप से उदासीन होते हैं। टॉमसन के मॉडल से परमाणु के उदासीन होने की क्या हो गई।
प्रश्न 2 – रदरफोर्ड के परमाणु मॉडल के अनुसार, परमाणु के नाभिक में कौन सा अवपरमाणुक कण विद्यमान है?
उत्तर :- रदरफोर्ड के परमाणु मॉडल के अनुसार, परमाणु के नाभिक में प्रोटॉन अवपरमाणुक कण विद्यमान होता है और ये अल्फ कण को विक्षेपित करता है।
प्रश्न 3 – तीन कक्षाओं वाले बोर के परमाणु मॉडल का चित्र बनाइए।
उत्तर :- छात्र स्वयं करें।
प्रश्न 4 – क्या अल्फ़ा कणों का प्रकीर्णन प्रयोग सोने के अतिरिक्त दूसरी धातु की पन्नी से संभव होगा?
उत्तर :- इन्होंने सोने की पन्नी इसलिए चुनी क्योंकि वे बहुत पतली परत चाहती थे। जो अन्य धातुओं में संभव नहीं है। सोने की यह पन्नी 1000 परमाणु के बराबर मोटी थी। अल्फ़ा कणों का प्रकीर्णन प्रयोग सोने के अतिरिक्त दूसरी धातु की पन्नी से संभव नहीं होगा।
पाठ के बीच में पूछे जाने वाले सवाल (पेज-56)
प्रश्न 1 – परमाणु के तीन अवपरमाणुक कणों के नाम लिखें।
उत्तर :- 1. इलेक्ट्रॉन 2. प्रोटॉन 3. न्यूट्रॉन
प्रश्न 2 – हीलियम परमाणु का परमाणु द्रव्यमान 4u है और उसके नाभिक में दो प्रोटॉन होते हैं। इसमें कितने न्यूट्रॉन होंगे?
उत्तर : हीलियम परमाणु का परमाणु द्रव्यमान 4u है और उसके नाभिक में दो प्रोटॉन होते हैं। इसमें दो न्यूट्रॉन होंगे।
⇒ 4 = 2 + न्यूट्रॉन
⇒ न्यूट्रॉन = 4 – 2 = 2
पाठ के बीच में पूछे जाने वाले सवाल (पेज-57)
प्रश्न 1 – कार्बन और सोडियम के परमाणुओं के लिए इलेक्ट्रॉन-वितरण लिखिए।
उत्तर : कार्बन परमाणुओं की संख्या =6
इलेक्ट्रॉन में भी परमाणुओं की संख्या =6
6 में से 2 इलेक्ट्रॉन K में जाता है और 4 इलेक्ट्रॉन L में जाता है।
तो कार्बन परमाणु की संख्या में इलेक्ट्रॉन वितरण 2 और 4 होगा।
सोडियम की परमाणु संख्या = 11
सोडियम इलेक्ट्रॉन परमाणु संख्या = 11
11 में से 2 इलेक्ट्रॉन K में जाता है और 8 L me जाता है।
एक M में जाता है सोडियम परमाणु की संख्या में इलेक्ट्रॉन वितरण 2, 8 और 1 होगा।
प्रश्न 2 – अगर किसी परमाणु का K और L कोश भरा है, तो उस परमाणु में इलेक्ट्रॉनों की संख्या क्या होगी?
उत्तर :- अगर किसी परमाणु का K और L कोश भरा है, तो उस परमाणु में इलेक्ट्रॉनों की संख्या 10 होगी।
पाठ के बीच में पूछे जाने वाले सवाल (पेज-58)
प्रश्न 1 – क्लोरीन, सल्फ़र और मैग्नीशियम की परमाणु संख्या से आप इनकी संयोजकता कैसे प्राप्त करेंगे?
उत्तर :- (1) क्लोरीन की परमाणु संख्या = 17
इलेक्ट्रॉनिक विन्यास = 2,8,7
संयोजकता संख्या = 1 होगी।
(2) सल्फ़र परमाणु संख्या = 16
इलेक्ट्रॉनिक विन्यास = 2,8, 6
संयोजकता संख्या = 2 होगी।
मैग्नीशियम की परमाणु संख्या = 12
इलेक्ट्रॉनिक विन्यास = 2,8,2
संयोजकता संख्या = 2 होगी।
पाठ के बीच में पूछे जाने वाले सवाल (पेज-59)
प्रश्न 1 – यदि किसी परमाणु में इलेक्ट्रॉनों की संख्या 8 है और प्रोटॉन की संख्या भी 8 है तब,
(a) परमाणु की परमाणु संख्या क्या है?
(b) परमाणु का क्या आवेश है?
उत्तर :- (a) परमाणु की परमाणु संख्या 0 होगा क्योंकि 8- 8 = 0
(b) परमाणु का कोई आवेश नहीं है ये उदासीन होता है।
प्रश्न 2 – सारणी 4.1 की सहायता से ऑक्सीजन और सल्फ़र-परमाणु की द्रव्यमान संख्या ज्ञात कीजिए।
उत्तर :- ऑक्सीजन और सल्फ़र-परमाणु की द्रव्यमान संख्या 32 है।
8+8= 16
16× 2= 32
पाठ के बीच में पूछे जाने वाले सवाल (पेज-60)
प्रश्न 1 – चिन्ह H, D और T के लिए प्रत्येक में पाए जाने वाले तीन अवपरमाणुक कणों को सारणीबद्ध कीजिए।
उत्तर :-
प्रोटियम (1H1) में
प्रोटॉन = 1, इलेक्ट्रॉन = 1 और न्यूट्रॉन = 0
ड्यूटीरियम (2H1 या D) में
प्रोटॉन = 1, इलेक्ट्रॉन = 1 और न्यूट्रॉन = 1
ट्राइटियम (3H1 या T) में
प्रोटॉन = 1, इलेक्ट्रॉन = 1 और न्यूट्रॉन = 2
प्रश्न 2 – समस्थानिक और समभारिक के किसी एक युग्म का इलेक्ट्रॉनिक विन्यास लिखिए।
उत्तर :- समस्थानिको को इस प्रकार परिभाषित किया जा सकता है, एक ही तत्व के परमाणु जिनकी परमाणु संख्या सामान लेकिन द्रव्यमान संख्या भिन्न होती है।
जैसे :- कार्बन, 12C, 14C
| K | L | |
| 12C-6 | 2 | 4 |
| 14C-6 | 2 | 4 |
परमाणुओं में प्रोटॉन की संख्या भिन्न – भिन्न है, दोनों तत्वों की द्रव्यमान संख्या 40 है यानी तत्वों के इस जोड़े में कुल संख्या सामान है। अलग-अलग परमाणु संख्या वाले तत्वों को जिनकी संख्या समान होती है समभारिक कहा जाता है।
जैसे :- 40Ca-20, 40Ar-16
| K | L | M | N | |
| 40Ca-20 | 2 | 8 | 8 | 2 |
| 40Ar-16 | 2 | 8 | 8 |
अभ्यास प्रश्न-उत्तर
प्रश्न 1 – इलेक्ट्रॉन, प्रोटॉन और न्यूट्रॉन के गुणों की तुलना कीजिए।
उत्तर :-
| गुण | इलेक्ट्रॉन | प्रोटॉन | न्यूट्रॉन |
| संकेत | e – | p+ | n |
| आवेश | -1 | +1 | 0 |
| द्रव्यमान | 9.109 x 10-31kg | 1.673 x 10-27kg | 1.673 x 10-27kg |
| एब्सोल्यूट आवेश | -1.6 x 10-19 | 1.6 x 10-19 | 0 |
प्रश्न 2 – जे. जे. टॉमसन के परमाणु मॉडल की क्या सीमाएँ हैं?
उत्तर :- जे.जे. टॉमसन के परमाणु मॉडल और रदरफोर्ड के परमाणु मॉडल से इसकी व्याख्या नहीं की जा सकती है। दूसरे वैज्ञानिकों द्वारा किए गए प्रयोगों के परिणामों को इस मॉडल के द्वारा समझा नहीं जा सका।
प्रश्न 3 – रदरफोर्ड के परमाणु मॉडल की क्या सीमाएँ हैं?
उत्तर :- परमाणु का केंद्र धनावेशित होता है जिसे नाभिक भी कहा जाता है। एक परमाणु का लगभग संपूर्ण द्रव्यमान नाभिक में होता है। इलेक्ट्रॉन नाभिक के चारो ओर वर्तुलाकर मार्ग में चक्कर लगाते हैं। नाभिक का आकार परमाणु के आकार की तुलना में काफी कम होता है।
प्रश्न 4 – बोर के परमाणु मॉडल की व्याख्या कीजिए।
उत्तर :- रदरफोर्ड के मॉडल पर उठी आपत्तियों को दूर करने के लिए नील्स बोर परमाणु की संरचना को प्रस्तुत किया।इस इलेक्ट्रॉन केवल कुछ निश्चित कक्षाओं में ही चक्कर लगा सकते हैं, जिन्हें इलेक्ट्रॉन की विविक्त कक्षा कहते हैं। जब इलेक्ट्रॉनिक विविक्त कक्षा में चक्कर लगाते हैं तो उनकी ऊर्जा का विकिरण नहीं होता है।
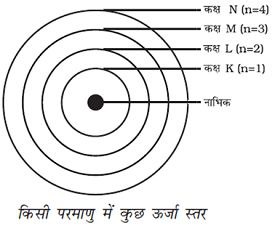
प्रश्न 5 – इस अध्याय में दिए गए सभी परमाणु मॉडलों की तुलना कीजिए।
उत्तर :- टॉमसन ने परमाणु की संरचना से संबंधित एक मॉडल प्रस्तुत किया, जो क्रिसमस केक की तरह था। इसके अनुसार परमाणु एक धनावेशित गोला था, जिसमें इलेक्ट्रॉन क्रिसमस केक में लगे सूखे मेवे की तरह थे। तरबूज का उदाहरण भी ले सकते हैं, जिसके अनुसार परमाणु में धन आवेश तरबूज के खाने वाले लाल भाग की तरह बिखरा है, जबकि इलेक्ट्रॉन धनावेशित गोले में तरबूज के बीज की भाति धसे हैं। +और – आवेश परिणाम में समान होते हैं। इसलिए परमाणु वैधुतीय रूप से उदासीन होते हैं।
रदरफोर्ड ने तेज़ चल रहे अल्फा कणों को सोने की पन्नी पर टकराया गया। इन्होंने सोने की पन्नी इसलिए चुनी क्योंकि वे बहुत पतली परत चाहते थे। सोने की यह पन्नी 1000 परमाणुओं के बराबर मोटी थी। अल्फा कण दिआवेशित हिलीयम कण होते हैं अत: ये धनावेशित होते हैं। इनका द्रव्यमान 4u होता है इसलिए तीव्र गति से चल रहे इन अल्फा कणों में पर्याप्त ऊर्जा होती है।
बोर का ये मॉडल इलेक्ट्रॉन केवल कुछ निश्चित कक्षाओं में ही चक्कर लगा सकते हैं, जिन्हें इलेक्ट्रॉन की विविक्त कक्षा कहते हैं। जब इलेक्ट्रॉनिक विविक्त कक्षा में चक्कर लगाते हैं, तो उनकी ऊर्जा का विकिरण नहीं होता है।
1932 में जे. चैडविक ने एक और अवपरमाणुक कण को खोज निकाला, जो अनावेशित और द्रव्यमान में प्रोटॉन के बराबर था। अतत: इसका नाम न्यूट्रॉन पड़ा। हाइड्रोजन को छोड़कर ये सभी परमाणु के नाभिक में होते हैं।समानत: न्यूट्रॉन को n से दर्शाया जाता है।परमाणु का द्रव्यमान नाभिक में उपस्थित प्रोटॉन और न्यूट्रॉन के द्रव्यमान के योग के द्वारा प्रकट किया जाता है।
प्रश्न 6 – पहले अठारह तत्वों के विभिन्न कक्षों में इलेक्ट्रॉन वितरण के नियम को लिखिए।
उत्तर :- इन नियमों के अनुसार किसी कक्षा में उपस्थित अधिकतम इलेक्ट्रॉनों की संख्या को सूत्र 2n2 से दर्शाया जाता है ,जहां n कक्षा की संख्या या ऊर्जा स्तर है। इसलिए इलेक्ट्रॉन की अधिकतम संख्या पहले कक्ष या K कोश में होगी = 2×12=2, दूसरे में कक्ष या L कोश में होगी 2 × 2 2 = 8, तीसरे कक्ष या M कोश में होगी =2 × 32=18, चौथे कक्ष या N कोश में होगी = 2×42= 32।
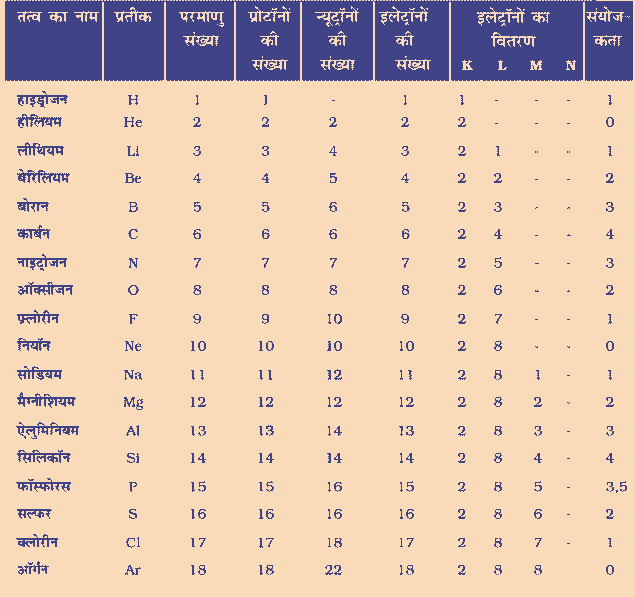
सबसे बाहरी कोश में इलेक्ट्रॉनों की अधिकतम संख्या 8 हो सकती है। किसी परमाणु के दिए गए कोश में इलेक्ट्रॉन तब तक स्थान नहीं लेते हैं जब तक कि उससे पहले वाले भीतरी कक्ष पूर्ण रूप से भर नहीं जाते। इससे स्पष्ट होता है कि कक्षाएं क्रमा अनुसार भरती हैं।
प्रश्न 7 – सिलिकॉन और ऑक्सीजन का उदाहरण लेते हुए संयोजकता की परिभाषा दीजिए।
उत्तर :- परमाणु की विभिन्न कक्षाओं (या कोशो) में इलेक्ट्रॉन किस प्रकार व्यवस्थित होते हैं। किसी परमाणु की सबसे बाहरी कक्ष में उपस्थित इलेक्ट्रॉन को संयोजकता इलेक्ट्रॉन कहा जाता है। सिलिकॉन परमाणु बाहयतम कक्ष में दो इलेक्ट्रॉन होते हैं और अन्य में 8 होते हैं। सक्रिय तत्वों के परमाणु की संयोजन – शक्ति अपने समान या अन्य किसी तत्व के परमाणु से मिलकर बनाने की प्रवृत्ति, अपने बाहयतम कक्ष को पूरे रूप से भरने का प्रयास माना जाता है।
ऑक्सीजन 8 इलेक्ट्रॉन वाले सबसे बाहरी कक्ष को अष्टक माना जाता है।परमाणु अपने अंतिम कक्ष में अष्टक प्राप्त करने के लिए क्रिया करते हैं। यह आपस में इलेक्ट्रॉनों की साझेदारी करने, उनको ग्रहण करने या उनका त्याग करने से होता है। परमाणु के बाहरी कक्ष में इलेक्ट्रॉन के अष्टक बनाने के लिए जितनी संख्या में इलेक्ट्रॉन की साझेदारी या स्थानांतर होता है वही उस तत्व की संयोजकता – शक्ति अर्थात संयोजकता होती है।
प्रश्न 8 – उदाहरण के साथ व्याख्या कीजिए: परमाणु संख्या, द्रव्यमान संख्या, समस्थानिक और समभारिक। समस्थानिको के कोई दो उपयोग लिखिए।
उत्तर :- कुछ तत्वों के परमाणु की पहचान की गई है, जिनकी परमाणु संख्या समान लेकिन द्रव्यमान संख्या अलग-अलग होती है। उदाहरण के लिए हाइड्रोजन परमाणु को ले। इसके 3 परमाणु स्पीशीज होते हैं: प्रोटियम, ड्यूटीरियम, टाइटियम ,टाइटन . प्रत्येक की परमाणु संख्या सामान है। लेकिन द्रव्यमान संख्या क्रमश: एक दो और तीन है। इस तरह के अन्य उदाहरण हैं। कार्बन और क्लोरिन। इन उदाहरणों के आधार पर समस्थानिको को इस प्रकार परिभाषित किया जा सकता है, एक ही तत्व के परमाणु जिनकी परमाणु संख्या सामान लेकिन द्रव्यमान संख्या भिन्न होती है। इस तरह हम कह सकते हैं कि हाइड्रोजन परमाणु के तीन समस्थानिको प्रोटियम, ड्यूटीरियम, टाइटियम होते हैं।
समभारिक दो तत्वों कैल्शियम, परमाणु संख्या 20 और आर्गन परमाणु संख्या 18 के बारे में विचार कीजिए। परमाणुओं में प्रोटॉन की संख्या भिन्न – भिन्न है, दोनों तत्वों की द्रव्यमान संख्या 40 है यानी तत्वों के इस जोड़े में कुल संख्या सामान है। अलग-अलग परमाणु संख्या वाले तत्वों को जिनकी संख्या समान होती है समभारिक कहा जाता है।
प्रश्न 9 – Na+ के पूरी तरह से भरे हुए K व L कोश होते हैं – व्याख्या कीजिए।
उत्तर :- Na परमाणु में इलेक्ट्रॉन संख्या = 11
सोडियम का इलेक्ट्रॉनिक विन्यास:
| K | L | M |
| 2 | 8 | 1 |
Na + आयन परमाणु में इलेक्ट्रॉन संख्या= 10
2 इलेक्ट्रॉन और 8 इलेक्ट्रॉन से K और L कोश भर जाएगा।
प्रश्न 10 – अगर ब्रोमीन परमाणु दो समस्थानिकों 79Br-35 (49.70%) तथा 81Br-35 (50.3%) के रूप में है, तो ब्रोमीन परमाणु के औसत परमाणु द्रव्यमान की गणना कीजिए।
उत्तर :- अगर ब्रोमीन परमाणु दो समस्थानिकों 79Br-35 (49.70%) तथा 81Br-35 (50.3%) के रूप में है, तो ब्रोमीन परमाणु के औसत परमाणु द्रव्यमान 80.006u होगा।
प्रश्न 11 – एक तत्व X का परमाणु द्रव्यमान 16.2u है तो इसके किसी एक नमूने में समस्थानिक 16X-8 और 18X-8 का प्रतिशत क्या होगा?
उत्तर :- एक तत्व X का परमाणु द्रव्यमान 16.2u है तो इसके किसी एक नमूने में समस्थानिक 16X-8 और 8X-8 का प्रतिशत 10% होगा।
प्रश्न 12 – यदि तत्व का Z = 3 हो तो तत्व की संयोजकता क्या होगी? तत्व का नाम भी लिखिए।
उत्तर :- परमाणु इलेक्ट्रॉन = 3
इलेक्ट्रॉन विन्यास = 2,1
तो इसकी संयोजकता = 1 होगी।
तत्व का नाम लिथियम है।
प्रश्न 13 – दो परमाणु स्पीशीज़ के केंद्रकों का संघटन नीचे दिया गया है:
| X | Y | |
| प्रोटॉन | 6 | 6 |
| न्यूट्रॉन | 6 | 8 |
X और Y की द्रव्यमान संख्या ज्ञात कीजिए। इस दोनों स्पीशीज़ में क्या संबंध है?
उत्तर : प्रोटॉन का द्रव्यमान संख्या = 6+6= 12
न्यूट्रॉन का द्रव्यमान संख्या= 6+8= 14
X और Y इस दोनों स्पीशीज़ में बराबर का संबंध है, लेकिन परमाणु द्रव्यमान संख्या अलग-अलग है।
प्रश्न 14 – निम्नलिखित वक्तव्यों में गलत के लिए F और सही के लिए T लिखें:
(a) जे. जे. टॉमसन ने यह प्रस्तावित किया था कि परमाणु के केंद्रक में केवल न्यूक्लीयॉन्स होते हैं।
(b) एक इलेक्ट्रॉन और प्रोटॉन मिलकर न्यूट्रॉन का निर्माण करते हैं इसलिए यह अनावेशित होता है।
(c) इलेक्ट्रॉन का द्रव्यमान प्रोटॉन से लगभग 1 2000 गुणा होता है।
(d) आयोडीन के समस्थानिक का इस्तेमाल टिंक्चर आयोडीन बनाने में होता है। इसका उपयोग दवा के रूप में होता है।
उत्तर : a. F
b. F
c.T
d. F
प्रश्न 15 – रदरफ़ोर्ड का अल्फा कण प्रकीर्णन प्रयोग किसकी खोज के लिए उत्तरदायी था-
(a) परमाणु केंद्रक
(b) इलेक्ट्रॉन
(c) प्रोटॉन
(d) न्यूट्रॉन
उत्तर :- रदरफ़ोर्ड का अल्फा कण प्रकीर्णन प्रयोग परमाणु केंद्रक खोज के लिए उत्तरदायी था।
प्रश्न 16 – एक तत्व के समस्थानिक में होते हैं-
(a) समान भौतिक गुण
(b) भिन्न रसायनिक गुण
(c) न्यूट्रॉनों की अलग-अलग संख्या
(d) भिन्न परमाणु संख्या
उत्तर :- एक तत्व के समस्थानिक में न्यूट्रॉनों की अलग-अलग संख्या होते हैं।
प्रश्न 17 – Cl– आयन में संयोजकता – इलेक्ट्रॉन की संख्या है –
(a) 16
(b) 8
(c) 17
(d) 18
उत्तर :- Cl– आयन में संयोजकता – इलेक्ट्रॉन की संख्या 8 है।
प्रश्न 18 – सोडियम का सही इलेक्ट्रॉनिक विन्यास निम्न में कौन सा है?
(a) 2, 8
(b) 7, 2, 1
(c) 2, 1, 8
(d) 2, 8, 1
उत्तर : सोडियम का सही इलेक्ट्रॉनिक विन्यास निम्न में से 2,8,1 है।
प्रश्न 19 – निम्नलिखित सारणी को पूरा कीजिए –
| परमाणु संख्या | द्रव्यमान संख्या | न्यूट्रोनों की संख्या | प्रोटोनों की संख्या | इलेक्ट्रोनों की संख्या | परमाणु स्पीशीज |
| 9 | – | 10 | – | – | – |
| 16 | 32 | – | – | – | सल्फर |
| – | 24 | – | 12 | – | – |
| – | 2 | – | 1 | – | – |
| – | 1 | 0 | 1 | 0 | – |
उत्तर :- परमाणु संख्या : 12,1,1
द्रव्यमान संख्या : 19
न्यूट्रोनों की संख्या : 16,12,1
प्रोटोनों की संख्या : 9,16,
इलेक्ट्रोनों की संख्या: 9,16,12,1
परमाणु स्पीशीज: फ्लोरीन, मैग्नीशियम, ड्यूटीरियम, H+










